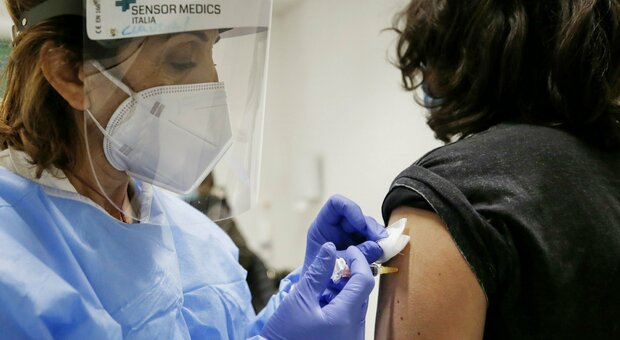
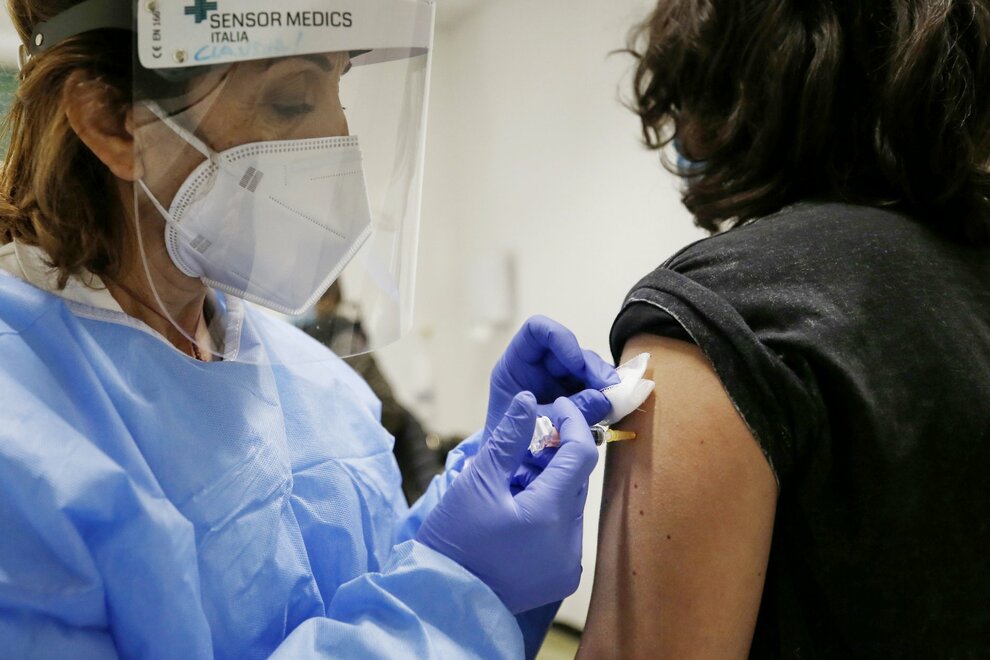
Vaccino anti-Covid, Pfizer e Biontech hanno presentato la richiesta di autorizzazione all'Ema, l'agenzia europea per i medicinali, mentre Astrazeneca ha annunciato che in 7 giorni verranno presentati i dati per l'approvazione.
Tempistica accelerata
L'Agenzia europea del farmaco ha ricevuto una domanda di autorizzazione all'immissione in commercio condizionale del vaccino sviluppato da BioNTech e Pfizer. Lo rende noto l'Ema. La valutazione procederà secondo una tempistica accelerata. Un parere sull'autorizzazione potrebbe arrivare entro poche settimane. Se i dati presentati sono sufficientemente solidi per trarre conclusioni sulla qualità, sicurezza ed efficacia del vaccino, il comitato scientifico per i medicinali per uso umano (Chmp) dell'EMA concluderà la sua valutazione durante una riunione straordinaria prevista per il 29 dicembre, al più tardi.
Le scadenze, spiega Ema in una nota, si basano sul tipo di dati valutati finora nel contesto della revisione continua e possono essere soggette a modifiche man mano che la valutazione procede. Durante la revisione e durante la pandemia, l'Agenzia è coadiuvata dalla task force pandemica EMA Covid-19, un gruppo che riunisce esperti provenienti da tutta la rete normativa europea dei medicinali per facilitare un'azione rapida e coordinata su medicinali e vaccini per Covid-19. L'autorizzazione all'immissione in commercio condizionata consente il via libera ai medicinali che rispondono a un'esigenza medica insoddisfatta sulla base di dati meno completi di quelli normalmente richiesti. Ciò accade nel contesto della pandemia, per rispondere prontamente alla minaccia per la salute pubblica. Tuttavia, specifica l'Ema, i dati «devono dimostrare che i benefici del medicinale o del vaccino superano i rischi». Una volta concessa l'autorizzazione condizionata, le aziende devono fornire ulteriori dati da studi in corso o nuovi entro scadenze predefinite per confermare che i benefici continuano a superare i rischi.
Tamponi, dal molecolare all'antigenico: quanti sono e a cosa servono
Vaccino Covid, il Comitato per la Bioetica: «È un bene comune, obbligatorio in casi di emergenza»
Arcuri: pronto piano vaccini, operativo per fine gennaio
Il piano esecutivo vaccinale è pronto, ma diventerà operativo quando i vaccini avranno le autorizzazioni di immissione in commercio: lo avrebbe detto il commissario Domenico Arcuri in videoconferenza con le Regioni, secondo quanto si apprende. La previsione è che le autorizzazioni possano arrivare per la fine di gennaio. Per i vaccini che dovranno essere conservati a -75 gradi ci saranno 300 posti di distribuzione, avrebbe ancora detto Arcuri.
Astrazeneca: in 7 giorni i dati per l'approvazione
Entro una settimana AstraZeneca consegnerà la documentazione per l'approvazione del vaccino (Oxford) alle agenzie regolatorie. Lo ha affermato Piero Di Lorenzo, presidente e amministratore delegato di Irbm Pomezia, che collabora allo sviluppo, ospite del programma «L'imprenditore e gli altri» su Cusano Italia Tv.
«La capogruppo AstraZeneca sta predisponendo tutta la documentazione, tutto il pacchetto da consegnare alle agenzie regolatorie - ha spiegato Di Lorenzo -. Confido che entro una settimana questo pacchetto sarà pronto e consegnato. A quel punto le agenzie regolatorie, con il rigore dovuto e con tutta la possibilità di controllare tutte le carte, potranno decidere se validare o meno il vaccino».
In questi giorni sulla sperimentazione del vaccino sono emersi dettagli, come un presunto errore nel dosaggio, che potrebbero far richiedere all'Fda un supplemento nei test. «Ho letto tante notizie sull'errore nella sperimentazione, mi permetto di dire che non si tratta di errore, ma è stato un caso fortuito, cosa che nella ricerca scientifica è quasi la norma - spiega Di Lorenzo -. Nel corso di queste ricerche, facendo l'esperimento di iniettare una dose iniziale più una di richiamo dopo un mese del candidato vaccino, si è visto che mettendo mezza dose la cosa funzionava molto meglio.
Vaccino Moderna, risposta Ema entro il 12 gennaio
Se i dati presentati da Moderna si dimostreranno sufficientemente solidi per trarre conclusioni sulla qualità, sicurezza ed efficacia del vaccino «la valutazione sarà conclusa al più tardi nella riunione straordinaria del comitato scientifico per i medicinali per uso umano dell'Ema, prevista per il 12 gennaio». È quanto indica la stessa Ema in una nota in cui dà notizia dell'avvenuta presentazione della domanda di autorizzazione da parte di Moderna.
Vaia: «Primi dati confortanti sul vaccino Spallanzani-ReiThera»
«I primi dati sulla fase I della sperimentazione del vaccino sono confortanti e li presenteremo a giorni». Lo ha evidenziato il direttore sanitario dell'Inmi Spallanzani di Roma, Francesco Vaia, ospite di 'Che giorno è' su Rai Radio 1, rispondendo alle domande sul candidato vaccino anti-Covid sviluppato dall'azienda ReiThera in collaborazione con lo Spallanzani e co-finanziato dalla Regione Lazio.
«Il vaccino è un bene comune e quanti più ce ne sono meglio è - ha sottolineato Vaia - Lo Spallanzani sarà in prima linea anche nella distribuzione dei primi vaccini che arriveranno. Aspettiamo però la valutazione delle autorità regolatorie sulla sicurezza e sull'efficacia», ha ribadito il direttore che ha rimarcato come sia «giusto che anche l'opionione pubblica sappia tutto sui vaccini». L'esperienza della pandemia «ci ha dimostrato che siamo molto nel campo dell'empirismo, bisogna procedere quindi con i piedi di piombo e anche i cittadini devono considerare - ha ricordato Vaia - che non c'è bisogno di fare fughe in avanti e adagiarsi sui lievi risultati positivi che stiamo ottenendo. Occorre sempre essere vigili nei comportamenti».
Nuovo Dpcm, Natale blindato: spostamenti tra regioni vietati dal 19 dicembre al 10 gennaio
ROMA Il duello vero e proprio andrà in scena questa mattina, quando i ministri Francesco Boccia e Roberto Speranza riuniranno in videoconferenza i governatori regionali. Ma già nelle ultime ore, come da copione consolidato di tutta l'emergenza-, le Regioni (in primis quelle di centrodestra) sono andate all'attacco delle misure restrittive che sta mettendo a punto l'esecutivo.
Ultimo aggiornamento: Mercoledì 30 Dicembre 2020, 12:55
© RIPRODUZIONE RISERVATA