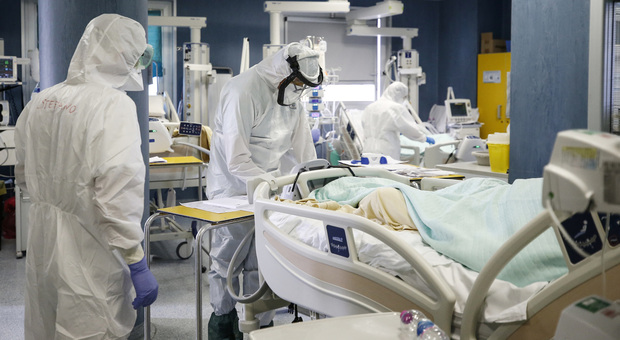
Coronavirus, brutta notizia sul fronte della sperimentazione degli anticorpi monoclonali in corso negli Stati Uniti. L'anticorpo sperimentale bamlanivimab, sviluppato dalla multinazionale Eli-Lilly, non funziona infatti nei pazienti ricoverati e in gravi condizioni.
Leggi anche > Coronavirus, infermiera si addormenta sul volante dell'ambulanza e la foto fa il giro del web: «Non siamo eroi»
La sperimentazione, coordinata dal National Institutes of Health (Nih) diretto dall'immunologo consulente della Casa Bianca Anthony Fauci, subisce così un brusco stop. In una nota la compagnia ha comunicato che, sulla base di un insieme di dati rivisti in data 26 ottobre, «nessun altro paziente Covid riceverà bamlanivimab nel contesto ospedaliero». Si interrompe quindi il trial Activ-3, mentre proseguono gli altri studi in corso sul trattamento.
«Sebbene non ci siano prove sufficienti che bamlanivimab migliori gli esiti clinici quando aggiunto ad altri trattamenti in pazienti ospedalizzati con Covid-19», sulla base dei dati di un altro studio (Blaze-1) l'azienda precisa di restare comunque «fiduciosa che la monoterapia con bamlanivimab possa prevenire la progressione della malattia nei pazienti diagnosticati precocemente».
Tutti gli altri studi su bamlanivimab rimangono quindi in corso, inclusi «Activ-2, studio sponsorizzato dagli Nih su pazienti con Covid-19 da lieve a moderata di recente diagnosi; Blaze-1, studio di fase 2 di Lilly in persone a cui è stata recentemente diagnosticata Covid-19 in ambiente ambulatoriale, su bamlanivimab in monoterapia e in combinazione con etesevimab; Blaze-2, studio di fase 3 di Lilly su bamlanivimab per la prevenzione di Covid-19 negli ospiti e nel personale delle strutture di assistenza a lungo termine». In particolare, forte dei «dati di Blaze-1, a inizio ottobre Lilly ha presentato alla Fda una richiesta di autorizzazione all'uso di emergenza (Eua) per bamlanivimab nel trattamento di Covid-19 da lieve a moderata di recente diagnosi».
Ultimo aggiornamento: Martedì 27 Ottobre 2020, 21:35
© RIPRODUZIONE RISERVATA